海关官宣:新增法检出口医疗物资采取验证管理,无需实施产地检验!
日期:2020-04-12 / 人气: / 来源:
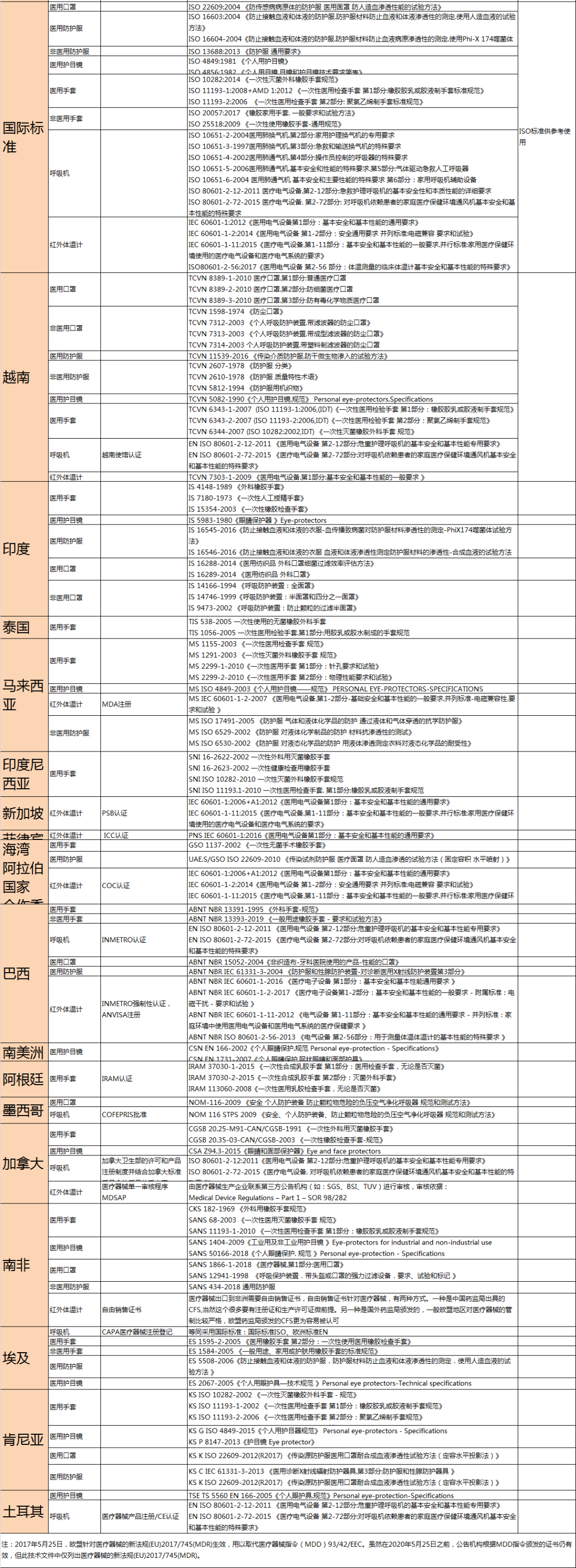
周五经历了一波三折的医疗物资出口商检“大战”,原以为会因为海关总属发布的53号公告尘埃落定,没想到又再次反转。 不同于其他出口法检商品,此次53号公告新增法检出口医疗物资采取的是验证管理方式,无需实施产地检验,报关时无需出口电子底账。企业只需正常申报报关单。 根据海关总署2020年第53号公告,自4月10日起,对“6307900010”等海关商品编号项下的11类医疗物资实施出口商品检验,共涉及19个HS编码。之前,对出口检测试剂已实施卫生检疫。 序号 类别 商品编号 监管证件 检验检疫类别 1 医用口罩 6307900010 N 2 医用防护服 6210103010 N 3926209000 N 3 红外测温仪 9025199010 N 4 呼吸机 9019200010 A M/N 9019200090 A M/N 5 医用手术帽 6505009900 N 6 医用护目镜 9004909000 N 7 医用手套 3926201100 N 3926201900 N 4015110000 N 4015190000 N 8 医用鞋套 6307900090 N 3926909090 N 4016999090 N 9 病员监护仪 9018193010 A M/N 10 医用消毒巾 3005901000 N 3005909000 N 11 医用消毒剂 3808940010 N 12 病毒检测试剂 3822009000 A/B V/W 对53号公告所列11类出口法检医疗物资企业通过单一窗口申报报关,不同于其他出口法检商品的是,此次新增法检出口医疗物资一般无需实施产地检验,报关时无需出口电子底账。 (1)对出口法检医疗物资,企业需在报关单商品名称栏填报用途,并注明是否医用,检测试剂需注明是否为新型冠状病毒检测用。 温馨提示: (2)对三部委“5号公告”所列(含公告后续调整所列)的出口新型冠状病毒检测试剂、医用口罩、医用防护服、呼吸机、红外体温计5类医疗物资,企业向海关报关时,须提供书面或电子声明和我国医疗器械产品注册证书。新冠病毒检测试剂还须提供药监部门出具的出口销售证明。 (3)对其他出口法检医疗物资,企业向海关报关时,应当提供医疗器械产品注册/备案证明和质量安全承诺声明。对无相关证明和承诺声明的,海关将实施严密监管。 (4)对新冠病毒检测试剂,发货人应当申请卫生检疫审批,凭《入/出境特殊物品卫生检疫审批单》通过单一窗口报检,经海关检验合格后,获得电子底账,报关时填写电子底账帐号。 郑重提示: 出口法检医疗物资应当符合进口国(地区)的要求,对进口国(地区)无质量安全标准要求的,应当符合我国质量安全标准。 医疗物资国内外质量安全标准可登陆“海关总署网站—总署概况—商品检验司—政策法规”栏目查询(不定期更新),访问地址:http://sjs.customs.gov.cn/sjs/zcfg56/index.html 部分国家(地区)防疫物资技术法规和标准要求(第三版),访问地址:http://sjs.customs.gov.cn/sjs/zcfg56/2963129/index.html 我国和国外部分国家(地区)防疫医疗物资质量安全标准和主要项目(第一版),访问地址:http://sjs.customs.gov.cn/sjs/zcfg56/2963129/index.html 按照中国和国外政府签订的双边协议,对出口至部分国家和地区的商品需申请实施装运前检验。 企业是出口医疗物资质量安全第一责任人,海关依法实施检验监管。出口属于掺杂掺假、以假充真、以次充好的商品或者以不合格进出口商品冒充合格进出口商品的,将依法依规严厉查处;构成犯罪的,依法追究刑事责任。 《海关实施出口医疗物资法定检验工作方案》的通知(署监发「2020」72号),内容摘要及解读如下: 按照72号文件要求,对于53号公告规定的11类(19个商品编码)出口法检医疗物资,采取的是验证管理方式,就是不需要做商品品质检验,无需出口电子底账,企业正常申报报关单。 单证提交要求:在三部委发布的“5号公告”里的5类医疗物资,提交医疗器械产品注册证和企业承诺声明;在三部委发布的“5号公告”外的医用物资,企业提交注册证和质量安全承诺书,非医用物资不要求提交注册证和质量安全承诺书。 海关审核要求:三部委5号公告涉及5类医疗物资,而海关53号公告涉及11类医疗物资。其中,4类相同,7类不相同。但都是对于医疗物资的新措施,不是对于非医疗物资的新措施。所以,海关申报系统中并没有对53号公告中的19个HS设置出口商检监管条件。海关采取电子审核加人工审单的方法,处理53号文件涉及的申报单证。涉及53号公告的出口防疫物资申报时,不需要电子底账,数据不走ECIQ系统。 三部委5号公告的4类商品按5号公告要求办理,需提供中国医疗器械产品注册证和企业承诺说明书,不需要做产品法定检验。对53号公告新增的7类商品,综合业务岗位几乎100%人工审单,发现未放行的可以联系海关审单部门。 对非医用的,若没被布控,直接放行;对医用的,需企业提供注册证书(可以是电子扫描件)及出口企业的质量承诺书,有上传的,原则上(被风险布控或者综合业务岗人工审单有疑问的、决定布控除外)予以放行,没有上述注册证书或者出口企业质量保证承诺书的,将可能被布控。 查验资料要求:如果产品涉及医疗物资,企业需提供注册/备案证明和质量安全承诺书。对于现场无法判定或企业提出异议的送实验室检测。72号文中明确了“在确定是否为医疗物资时,应根据商品本身特征而非申报用途”。 出口医疗物资需要符合国内出口标准,同样也需要遵循国外的进口标准。
4月11日,海关发布紧急通知,对于53号公告的具体操作做出了新的解释。
同一HS编码下既有医疗物资又有非医疗物资的,应根据商品本身特征即生产制造标准,确定是否医用。
企业必须按规定如实向海关申报,对将医用物资伪报为非医用物资的,依法从重处罚;涉嫌构成犯罪的,移送地方公安机关追究刑事责任。
再次声明: